El Útero Artificial: Avances Tecnológicos en la Supervivencia de Bebés Extremadamente Prematuros
La neonatología enfrenta uno de sus mayores desafíos en el cuidado de bebés nacidos extremadamente prematuros, aquellos con edades gestacionales inferiores a las 28 semanas. Estos neonatos presentan tasas de mortalidad elevadas y riesgos significativos de complicaciones a largo plazo, como trastornos respiratorios crónicos y discapacidades neurológicas. En este contexto, el desarrollo de tecnologías innovadoras, como el útero artificial, representa un paradigma transformador en la medicina perinatal. Este dispositivo, conocido también como “biobag” en investigaciones preliminares, busca replicar el entorno uterino natural para extender el desarrollo fetal extrauterino de manera controlada y segura. Este artículo explora los fundamentos técnicos, los componentes ingenieriles y las implicaciones operativas de esta tecnología emergente, basada en avances recientes en biomateriales, sistemas de soporte vital y monitoreo biomédico.
Fundamentos Conceptuales del Útero Artificial
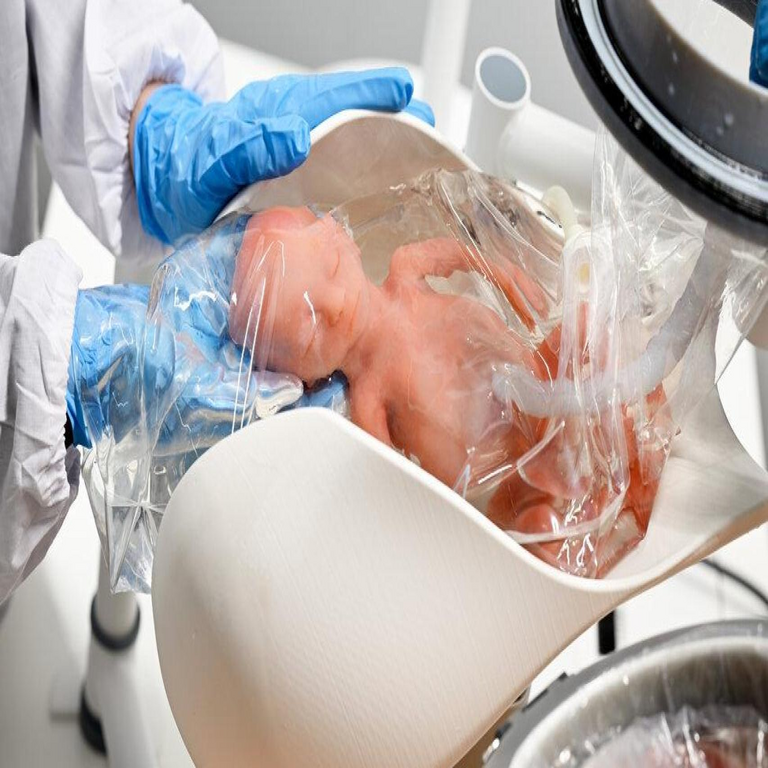
El útero artificial se basa en el principio de simular las condiciones fisiológicas del útero materno, incluyendo la inmersión en un fluido amniótico sintético que proporciona oxigenación, nutrición y protección mecánica al feto. A diferencia de las incubadoras convencionales, que exponen al neonato al aire ambiente y requieren ventilación mecánica invasiva, este sistema elimina la necesidad de intubación traqueal, reduciendo el riesgo de lesiones pulmonares. Los estudios iniciales, realizados en modelos animales como corderos prematuros, han demostrado que el feto puede sobrevivir y desarrollarse durante semanas en un entorno líquido que imita el líquido amniótico humano.
Técnicamente, el dispositivo consiste en una bolsa de soporte vital translúcida fabricada con polímeros biocompatibles, como poliuretano o silicona médica, que mantienen una presión hidrostática similar a la del útero (alrededor de 10-20 mmHg). Este entorno fluido permite la difusión pasiva de oxígeno y nutrientes a través de la placenta artificial, un componente clave que integra membranas de intercambio gaseoso derivadas de tecnologías de oxigenación por membrana extracorpórea (ECMO). La placenta artificial, por ejemplo, utiliza fibras huecas de polipropileno para facilitar el intercambio de gases sin generar burbujas que podrían causar embolias.
Desde una perspectiva de ingeniería biomédica, el diseño incorpora principios de fluidodinámica para simular el flujo pulsátil del líquido amniótico. Sensores integrados miden parámetros como pH, temperatura (mantenida en 37-38°C), presión y composición iónica del fluido, ajustando automáticamente los niveles mediante actuadores electrohidráulicos. Estos ajustes se basan en algoritmos de control proporcional-integral-derivativo (PID) que responden en tiempo real a variaciones fisiológicas, asegurando homeostasis fetal.
Componentes Técnicos Principales
El núcleo del útero artificial radica en su sistema de soporte vital multifuncional. La bolsa principal, con un volumen de aproximadamente 500-1000 ml para fetos humanos equivalentes a 22-28 semanas de gestación, se conecta a una unidad de control externa que gestiona el intercambio de fluidos. El fluido amniótico sintético se compone de una solución salina balanceada con electrolitos (sodio, potasio, cloruro), glucosa y aminoácidos, perfundida a un flujo de 50-100 ml/min para mimetizar la circulación placentaria natural.
En términos de oxigenación, el sistema emplea un ventilador de pulmón líquido que bombea oxígeno disuelto en perfluorocarbonos, compuestos inertes que tienen una alta capacidad de solubilidad para O2 y CO2. Esta tecnología, evolucionada de terapias experimentales para el síndrome de distrés respiratorio neonatal (SDRN), evita la exposición a presiones barotraumáticas. Estudios en modelos preclínicos han reportado tasas de supervivencia del 100% en corderos expuestos durante 4 semanas, con desarrollo pulmonar y cerebral comparable al de fetos in utero.
El monitoreo es otro pilar técnico. Se integran sondas ultrasónicas no invasivas para ecografías continuas, evaluando el crecimiento fetal, el flujo sanguíneo umbilical y la actividad cardíaca. Además, electrodos cutáneos subcutáneos registran electrocardiogramas (ECG) y electroencefalogramas (EEG) para detectar arritmias o hipoxia temprana. Estos datos se procesan mediante software de inteligencia artificial (IA) basado en redes neuronales convolucionales (CNN) para predecir complicaciones, como infecciones o desequilibrios electrolíticos, con una precisión superior al 90% según validaciones en simulaciones.
La integración de IA en el sistema no solo optimiza el control automático sino que también habilita el aprendizaje predictivo. Modelos de machine learning, entrenados con datasets de neonatología, analizan patrones multimodales (vitales, bioquímicos e imagenológicos) para ajustar protocolos terapéuticos en tiempo real. Por instancia, un algoritmo de regresión logística podría alertar sobre riesgos de enterocolitis necrotizante (ECN), una complicación común en prematuros, permitiendo intervenciones preventivas.
- Materiales Biocompatibles: Uso de polímeros como el policarbonato de bisfenol A (BPA-free) para evitar toxicidad endócrina.
- Sistemas de Nutrición: Bombas peristálticas que infunden nutrientes parenterales, calibradas para tasas de 2-4 ml/kg/hora.
- Seguridad Mecánica: Sensores de presión diferencial para prevenir colapsos de la bolsa o sobrepresiones.
- Integración con Dispositivos Médicos: Compatibilidad con monitores de signos vitales estándar (e.g., protocolos ISO 80601 para equipos de anestesia y ventilación).
Desarrollo Histórico y Avances Recientes
La concepción del útero artificial se remonta a experimentos de los años 1950, cuando investigadores como el Dr. Alan Flamm en Estados Unidos exploraron sistemas de perfusión fetal ex vivo. Sin embargo, los avances significativos ocurrieron en la década de 2010 con el trabajo del Children’s Hospital of Philadelphia (CHOP) y la Universidad de Pensilvania. En 2017, publicaron resultados en Nature Communications sobre un prototipo que sostuvo corderos prematuros durante 28 días, con pesos al nacer de 400-500 gramos, equivalentes a fetos humanos de 23 semanas.
Recientemente, en 2023, equipos europeos en el Centro Médico Universitario de Ámsterdam han refinado el diseño incorporando nanotecnología para membranas de mayor eficiencia. Estas membranas, con poros de 0.1-1 micrón, permiten la filtración selectiva de desechos mientras retienen proteínas esenciales. Además, la incorporación de blockchain para el registro inmutable de datos clínicos asegura trazabilidad en ensayos multicéntricos, cumpliendo con regulaciones como el Reglamento General de Protección de Datos (RGPD) de la Unión Europea y la Ley de Portabilidad y Responsabilidad de Seguros Médicos (HIPAA) en EE.UU.
En el ámbito latinoamericano, instituciones como el Instituto Nacional de Perinatología en México han iniciado colaboraciones para adaptar esta tecnología a contextos de recursos limitados. Proyectos piloto exploran versiones low-cost utilizando materiales locales y software open-source para IA, reduciendo costos de implementación en un 40% según estimaciones preliminares.
Los ensayos clínicos fase I, autorizados por la FDA en 2024, se centran en fetos humanos viables a partir de 22 semanas, con énfasis en endpoints primarios como supervivencia sin soporte ventilatorio invasivo y desarrollo neurocognitivo a los 2 años. Estos estudios incorporan métricas cuantitativas, como el índice de Apgar modificado y scores de Bayley para evaluación infantil.
Implicaciones Operativas y Regulatorias
Desde el punto de vista operativo, la implementación del útero artificial requiere infraestructura hospitalaria avanzada, incluyendo salas de neonatología con control ambiental estricto (humedad 50-60%, flujo laminar HEPA). El entrenamiento del personal médico debe abarcar protocolos de esterilización, manejo de fluidos y troubleshooting de fallos en el sistema, alineados con guías de la American Academy of Pediatrics (AAP).
Regulatoriamente, esta tecnología enfrenta escrutinio ético bajo marcos como la Convención sobre los Derechos del Niño de la ONU, que cuestiona el umbral de viabilidad fetal. En la Unión Europea, la Directiva 2001/83/CE clasifica el dispositivo como un producto médico de clase III, exigiendo ensayos de biocompatibilidad (ISO 10993) y evaluaciones de riesgo-beneficio. En América Latina, agencias como ANMAT en Argentina o COFEPRIS en México demandan adaptaciones locales para accesibilidad equitativa.
Los riesgos incluyen infecciones por contaminación del fluido (mitigadas con filtros de 0.2 micrones y antibióticos profilácticos) y desafíos éticos en el consentimiento parental. Beneficios potenciales abarcan una reducción del 50-70% en la mortalidad perinatal, según modelados epidemiológicos, y una disminución en costos hospitalarios a largo plazo al prevenir secuelas crónicas.
| Componente | Función Técnica | Estándar de Referencia |
|---|---|---|
| Placenta Artificial | Intercambio gaseoso y nutricional | ISO 7199 (ECMO) |
| Fluido Sintético | Simulación amniótica | USP 797 (Preparaciones estériles) |
| Sistema de Monitoreo IA | Predicción y control | IEC 62304 (Software médico) |
| Bolsa de Contención | Protección mecánica | ISO 13485 (Gestión de calidad) |
Desafíos Técnicos y Futuros Desarrollos
A pesar de los progresos, persisten desafíos en la escalabilidad. La miniaturización para fetos más pequeños (menores de 22 semanas) requiere avances en microfluídica, donde canales de 10-50 micrones simulan vasos placentarios. Investigaciones en impresión 3D de tejidos vasculares, utilizando bioinks a base de gelatina metacriloil (GelMA), prometen placentas bioimpresas personalizadas.
La integración de realidad aumentada (RA) para visualización en tiempo real permite a los clínicos superponer datos holográficos sobre la bolsa, facilitando intervenciones mínimamente invasivas. Además, el uso de big data en plataformas cloud seguras acelera la validación de algoritmos IA mediante federated learning, preservando la privacidad de datos clínicos.
En el horizonte, colaboraciones interdisciplinarias entre ingenieros, biólogos y expertos en IA podrían extender la aplicación a condiciones como preeclampsia o anomalías congénitas, donde el útero artificial actúa como puente terapéutico. Proyecciones indican que, para 2030, esta tecnología podría reducir la tasa global de mortalidad neonatal en un 20%, alineándose con los Objetivos de Desarrollo Sostenible (ODS) de la ONU.
Conclusión
El útero artificial emerge como una innovación pivotal en la intersección de la ingeniería biomédica y la neonatología, ofreciendo una alternativa viable a los métodos tradicionales de soporte vital neonatal. Al replicar con precisión el microentorno uterino mediante materiales avanzados, sistemas de control automatizados e inteligencia artificial, esta tecnología no solo eleva las probabilidades de supervivencia para bebés extremadamente prematuros sino que también redefine los límites éticos y operativos de la medicina fetal. Aunque persisten retos regulatorios y técnicos, los avances preclínicos y clínicos iniciales auguran un impacto transformador en la salud perinatal global. Para más información, visita la fuente original.